سینتک شیمیایی
جهان امروز از نداشتن دارویی به نام پرهیز و اخلاق رنج می برد. (ماری کوری)سینتک شیمیایی
جهان امروز از نداشتن دارویی به نام پرهیز و اخلاق رنج می برد. (ماری کوری)ساز و کار واکنش های شیمیایی
اغلب واکنش ها طی یک سری مراحل موسوم به مکانیسم ( ساز و کار ) واکنش انجام می شوند . کندترین مرحله در ساز و کار واکنش سرعت کل واکنش را تعیین می کند .
بررسی جز به جز مراحل انجام یک واکنش شیمیایی را ساز و کار واکنش (مکانیسم واکنش ) گویند . یا بررسی مراحل انجام یک واکنش را در سطح مولکولی مکانیسم آن واکنش گویند .
در کادر زیر مثال هایی از واکنش های بنیادی ( تک مرحله ای ) را ملاحظه می نمایید . برای چنین واکنش هایی براحتی می توان رابطه قانون سرعت را نوشت . و همجنانکه ملاحظه می شود مرتبه واکنش نسبت به هریک از اجزا با ضریب استوکیومتری آن برابر است .
| Molecularity | Elementary step | Rate law |
|---|---|---|
| 1 | A -> products | rate = k [A] |
| 2 | A + A -> products A + B -> products | rate = k [A]2 rate = k [A] [B] |
| 3 | A + A + A -> products A + 2 B -> products A + B + C -> products | rate = k [A]3 rate = k [A] [B]2 rate = k [A] [B] [C] |
برای کسب اطلاعات بیشتر اینجا را کلیک کنید .
مثال حل شده :
برای واکنش تجزیه هیدروژن پراکسید در حضور یون یدید اطلاعات زیر از طریق پنج آزمایش بدست آمده است
| 2 H2O2(aq) | --> | 2 H2O(aq) + O2(g) |
| Initial (H2O2) (M) | Initial (I-) (M) | Initial Instantaneous Rate of Reaction (M/s) | ||||
| آزمایش 1 | 1.0 x 10-2 | 2.0 x 10-3 | 2.3 x 107 | |||
| آزمایش 2 | 2.0 x 10-2 | 2.0 x 10-3 | 4.6 x 107 | |||
| آزمایش 3 | 3.0 x 10-2 | 2.0 x 10-3 | 6.9 x 107 | |||
| آزمایش 4 | 1.0 x 10-2 | 4.0 x 10-3 | 4.6 x 107 | |||
| آزمایش 5 | 1.0 x 10-2 | 6.0 x 10-3 | 6.9 x 107 |
رابطه ی قانون سرعت را برای این واکنش نوشته و مرتبه واکنش را نسبت به هریک از اجزا مشخص نمایید ؟
حل :
از مقایسه آزمایش های ۱و۲ داریم :

با دو برابر شدن غلظت هیدروژن پراکسید ( آب اکسیژنه ) سرعت واکنش نیز دوبرابر شده پس مرتبه ی واکنش نسبت به آن برابر 1 است .
از مقایسه آزمایش های ۱و ۳ داریم :

به طور مشابهی با سه برابر شدن غلظت هیدروژن پراکسید ( آب اکسیژنه ) سرعت واکنش نیز سه برابر شده پس مرتبه ی واکنش نسبت به آن برابر 1 است .
از طرف دیگر با مقایسه آزمایش های ۱و ۴ داریم :

با دو برابر شدن غلظت یون یدید سرعت واکنش نیز دوبرابر شده پس مرتبه ی واکنش نسبت به آن برابر 1 است .
و در نتیجه رابطه ی قانون سزعت به صورت زیر خلاصه می شود .
Rate = k[H2O2][I- ]
برای کنترل پاسخ به این لینک مراجعه نمایید .
مثال :
اگر در واکنش :
2 NO2 + F2 = 2 NO2F
ساز و کار واکنش به صورت زیر باشد :
i. NO2 + F2 = NO2F + F (slow)
ii. NO2 + F = NO2F (fast)
رابطه قانون سرعت برای این واکنش جیست ؟
توجه : در یک واکنش چند مرحله ای مرحله آهسته یا آهسته ترین مرحله تعیین کننده سرعت کل واکنش است .
کاتالیز گرها و تاثیر آن بر سرعت واکنش
کاتالیزگر ماده ای است که سرعت واکنش را زیاد می کند و خود دچار تغییر دائم نمی شود .
باید توجه داشت که یک کاتالیزگر طوری مکانیسم واکنش را تغییر می دهد که به انرژی فعالسازی کمتری نیاز دارد .
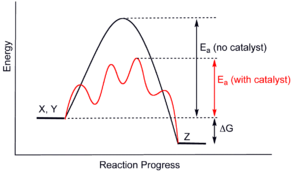
نمودار پیشرفت واکنش با کاتالیزگر و بدون کاتالیزگر
نکته قابل توجه آنست که کاتالیز گر محتوای انرژی واکنش دهنده ها و فراورده ها را تغییر نمی دهد در نتیجه بر مقدار آنتاپی واکنش بی اثر است .
معمولا یک واکنش با کاتالیزگر و بدون کاتالیزگر فراورده یا فراورده های واحدی را بوچود می آورد .
همچنانکه ملاحظه می شود ممکن است یک واکنش یک مرحله ای در حضور کاتالیزگر به یک واکنش چند مرحله ای تبدیل گردد .
انواع واکنش های کاتالیز شده:
واکنش های کاتالیز شده دو نوعند :
1)همگن : که در آن کاتالیزگر و واکنش دهنده ا در یک فاز هستند . مانند واکنش تجزیه هیدروژن پراکسید در حضور یون های آهن (اا)
مثال دیگر از این نوع واکنش ها تخریب اوزون در استراتوسفر در حضور اتم های کلر است .
ناهمگن : که در آن کاتالیزگر و واکنش دهنده ها در یک فاز نیستند . مانند واکنش تجزیه هیدروژن پراکسید در حضور منگنز دی اکسید
مثال دیگر برای واکنش های کاتالیز شده ی ناهمگن تجزیه ی دی نیتروِژن اکسید در سطح طلا است .
2N2O(g) -Au-->2 N2(g) + O2(g)
واکنش هیدروژن دار شدن اتن در سطح نیکل نیز نمونه ای دیکر از واکنش های کاتالیز شده ی ناهمگن می باشد :
همچنانکه ملاحظه می شود این فرایند شامل ۴ مرحله است .
آنزیم ها نیز نمونه هایی از کاتالیز گرهای طبیعی هستند که موچب افزایش سرعت واکنش های شیمیایی در سامانه های بیولوژیکی می شوند .
به عنوان مثال :
ایمیشن زیر نمونه ای از عملکرد یک آنزیم را نمایش می دهد :ببینیم